众所周知,多细胞生物在发育过程中,存在着多种预定的、受到精确控制的细胞程序性死亡,例如细胞凋亡(Apoptosis)、程序性坏死(Necroptosis)、细胞焦亡(Pyroptosis),以及铁死亡(Ferroptosis)等。
就在近日,2022年3月17日,哈佛-MIT博德研究所的研究人员在国际顶尖学术期刊 Science 上发表了题为:Copper induces cell death by targeting lipoylated TCA cycle proteins 的研究论文。
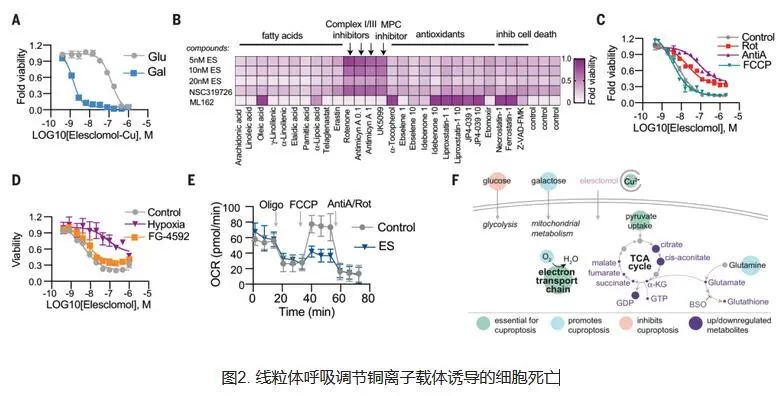
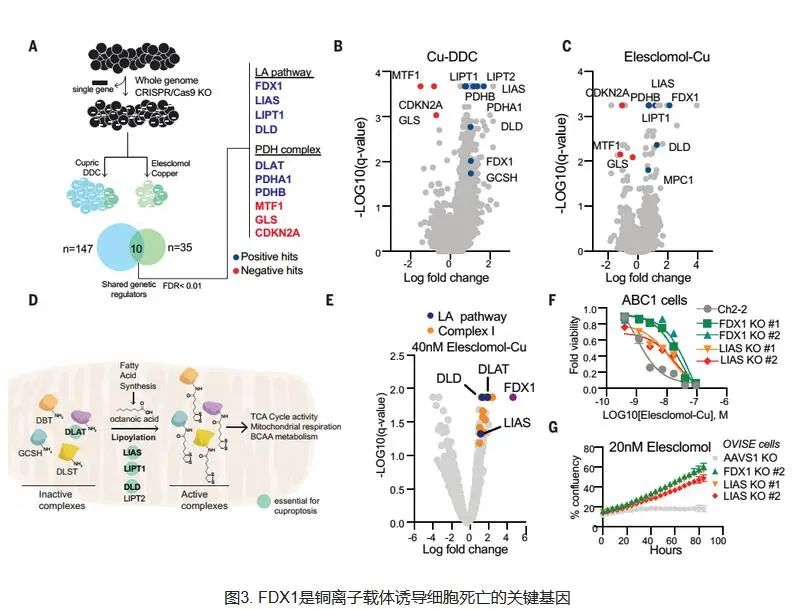
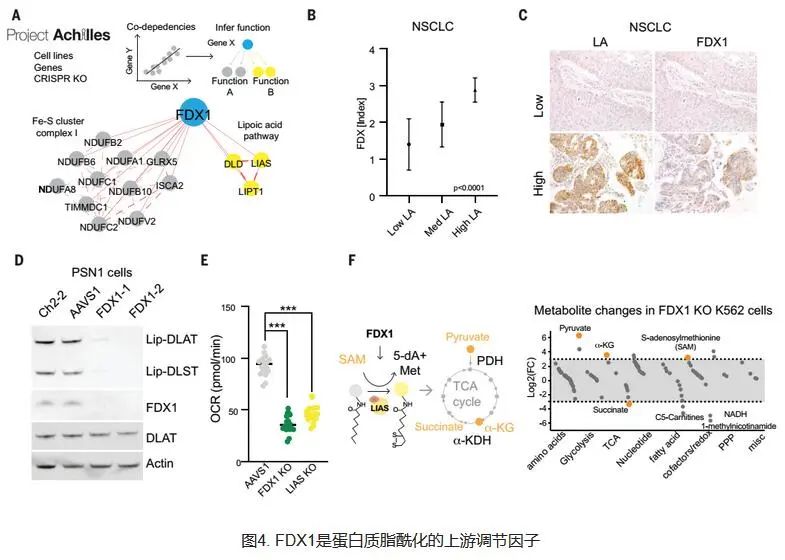
Todd Golub 团队从2019年开始一直致力于研究铜死亡的相关机制,他们发现了两种可以将铜离子运载穿过细胞膜的小分子,这种铜载体可以杀死特定的耐药癌细胞。其中一种分子Elesclomol还作为潜在抗癌药物进入了临床试验,但最终并未在在癌症患者身上显示出疗效,当时也还不清楚这种分子究竟是如何发挥作用的。团队发现,与铜离子结合的分子会杀死细胞,而且这种细胞死亡方式不同于已知的细胞死亡方式,因此他们决定进一步探索铜是如何杀死癌细胞的。研究团队首先开始验证铜载体的细胞毒性源于铜本身的假设,他们发现,许多不同的与铜例子结合分子或离子载体以类似的方式诱导细胞死亡,并且这一过程完全取决于铜的可用性。当研究团队阻断已知的细胞死亡方式(例如细胞凋亡、铁死亡等等)时,用铜载体处理的细胞仍然会死亡。研究团队认为这是一种新的细胞死亡方式,并将其命名为——Cuprotosis(铜死亡)。 下面我们来具体看看这项研究究竟做了些什么? 细胞死亡是一个必不可少的且需微调的过程,对于去除受损和多余的细胞至关重要。已经鉴定了多种形式的程序性和非程序性细胞死亡,包括细胞凋亡,铁死亡和细胞坏死。Tsvetkov等人研究了异常的铜离子升高是否会使细胞对先前未知的死亡途径敏感(请参阅Kahlson和Dixon的观点)。铜是所有生物必不可少的辅助因子,但是如果浓度超过进化上保守的稳态机制所维持的阈值,铜就会变得有毒。然而,过量的铜如何诱导细胞死亡尚不清楚。通过进行CRISPR/Cas9筛选,鉴定了几种可以防止铜诱导的细胞杀伤的基因。研究人员使用转基因细胞和铜超载疾病的小鼠模型报告表明,过量的铜会促进脂酰化蛋白的聚集,并将线粒体代谢与铜依赖性死亡联系起来。麻省理工学院和哈佛大学Broad研究所的Peter Tsvetkov和Todd R. Golub团队发现了这种由铜引起的细胞死亡的新形式-铜死亡。 研究人员首先在489个细胞系中测试了1448个载铜药物对细胞的杀伤效果,结果表明载铜药物elesclomol对几乎所有的细胞系均有杀伤作用。但是,改变这些化合物的铜结合能力会导致细胞杀伤能力的丧失。于是,研究人员以铜结合分子Elesclomol为研究对象,发现单独加入Elesclomol不影响细胞的生长,而一旦加入铜离子,细胞生长受到极大抑制。相反,加入其他金属,例如铁、钴、锌、镍等,未能增强细胞死亡,这些结果表明铜离子载体诱导的细胞死亡主要依赖于细胞内铜的积累。为进一步验证铜对细胞的影响,研究人员使用丁硫胺酸亚砜胺(BSO,消耗细胞内铜螯合剂谷胱甘肽)联合Elesclomol处理细胞,结果同样诱导细胞死亡。而采用四硫代钼酸盐(TTM,一种铜螯合剂)联合Elesclomol处理细胞,则细胞生长不受影响。这些结果表明,铜离子载体诱导的细胞死亡主要依赖于细胞内铜的积累。更重要的是,研究人员发现铜离子载体诱导的细胞死亡是一种新的细胞死亡途径,明显区别于传统死亡方式(凋亡,铁死亡,坏死)。 研究人员观察到更依赖线粒体呼吸的细胞对铜离子的敏感性比进行糖酵解的细胞高近1000倍。如果采用药物干预线粒体功能后,细胞对铜离子的敏感性发生显著变化。通过乏氧条件培养细胞,研究人员进一步证实了铜诱导的细胞死亡需要线粒体呼吸参与,而糖酵解产生的ATP方式,对铜诱导的细胞死亡影响较小(梅斯小编:这提示肿瘤细胞似乎更耐受铜死亡?)。 进一步研究人员发现铜并不直接参与电子传输链(ETC),而只是在三羧酸(TCA)循环中发挥作用。经代谢组学研究发现,对铜敏感细胞中与TCA相关的代谢物明显更多。这些结果表明铜诱导的细胞死亡与线粒体代谢之间紧密联系,铜与TCA循环之间息息相关。 发现影响铜离子载体关键基因FDX1 为了确定介导铜毒性的特定代谢途径,研究人员通过多重CRISPR基因敲除筛选,确定了促进铜诱导死亡的关键基因--铁氧还原蛋白1(FDX1),发现该基因编码一种Elesclomol可直接靶向的蛋白,该蛋白可将二价铜离子转化更毒的一价铜离子。FDX1基因此前还发现在肺癌,PCOS等中起重要作用。 发现敲除FDX1会减弱铜离子载体诱导的细胞死亡。此外,当细胞在糖酵解条件下生长时,大多数铜离子载体(如elesclomol、disulfiram和NSC319726)失去了杀伤活性。这些结果进一步说明铜与线粒体代谢联系十分紧密,而且与FDX1有关。 FDX1作为蛋白质脂酰化的上游调节因子发挥作用 研究人员发现敲除FDX1或脂酰化相关酶可以使细胞免于铜毒性。因此,作者猜测FDX1可能是蛋白质脂酰化的上游调节因子。为了验证这一猜测,作者首先通过检索公共数据库,发现FDX1和硫辛酸代谢与细胞存活高度相关。其次,作者对208例人类肿瘤标本进行了FDX1和硫辛酸的免疫组织化学染色,进行了半定量分析,结果发现FDX1和脂酰化蛋白的表达高度相关。 最后,作者通过免疫印迹和免疫组织化学检测,发现FDX1基因敲除导致蛋白质脂酰化完全丧失,同时也导致细胞呼吸显著下降。这些结果均表明FDX1是蛋白质脂酰化的上游调节因子。此外,作者还发现铜干扰铁硫簇,而铁硫簇是几种关键代谢酶的一部分。当这种酶降低时,细胞更容易死亡。 总的来说,该研究提出了铜依赖性的新型细胞死亡方式——Cuprotosis(铜死亡),并进一步揭示了铜死亡的具体机制。这些发现将有助于研究铜失调疾病(例如威尔逊病)。

 在线客服1号
在线客服1号




