Uniclone One Step Seamless Cloning Kit
产品组成
| 组分 | 规格(50 次) |
| 2×Uniclone Seamless Cloning Mix | 250 μL |
| pUC19 Control Plasmid,Linearized(Ampr,40 ng/μl) * | 5 μL |
| Control Fragment(500 bp,20 ng/μl)** | 5 μL |
*线性化载体,可与试剂盒提供的线性化片段重组,排除实验其他影响因素;
**线性化片段,可与试剂盒提供的线性化载体重组,排除实验其他影响因素。
保存条件
-20℃保存 12 个月,避免反复冻融。
产品简介
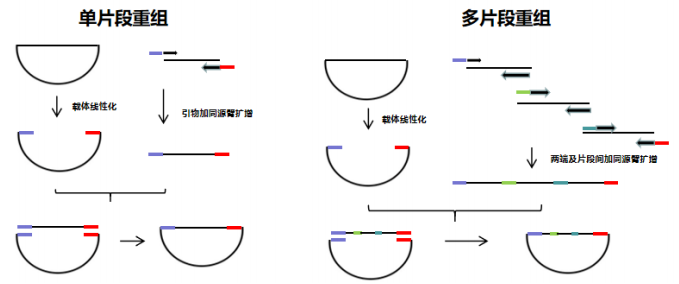
Uniclone One Step Seamless Cloning Kit 是基于同源重组原理开发的一款简单、快速、高效的无缝克隆试剂盒,能够将任意含有载体末端重叠区域的 DNA 片段重组至线性化载体上,不受酶切位点限制,载体自连背景极低。该方法的实现需要在插入片段正/反向 PCR 引物的 5’端引入线性化载体上的 15~25 nt 末端序列,通过重组酶的作用使得具有重叠区域的片段和载体最快在 50℃ 5 min 内重组,完成无缝克隆。
本产品可同时实现 1~5 个 DNA 片段的重组,2×Uniclone Seamless Cloning Mix 中添加的辅助因子和优化的反应体系使产品具有更高的阳性率和兼容性。
原理示意图
产品特点
快速:可在 5~60 min 内完成重组;
简单:不受酶切位点的限制,无需对片段酶切;
无缝:不引入额外序列。
适用范围
适用于 1~5 个片段的快速无缝克隆、定点突变和高通量克隆等实验。
使用方法
操作示例
1. 线性化载体的制备
选择合适的克隆区域对载体进行线性化(尽量选择无重复序列且 GC 含量均匀的区域),线性化的方法有酶切制备和反向 PCR 扩增制备。
1)酶切制备
推荐使用双酶切使载体线性化更完全,以降低转化背景。使用单酶切线性化载体时,可以适当延长酶切时间以减少环状质粒残留。平末端或粘末端均可,但务必保证酶切完全。
注意:
a. 经双酶切进行线性化的载体无需去磷酸化,单酶切则需要去磷酸化;
b. 酶切完成后,应快速将内切酶失活或对目的产物纯化后再用于重组反应;
c. 酶切后进行胶回收纯化,推荐纯化后通过琼脂糖凝胶电泳检测产物,可同时与 DNA Marker比较亮度检测浓度。
2)反向 PCR 扩增制备
推荐使用高保真聚合酶扩增减少碱基突变的概率。推荐使用预线性化质粒为模板,以减少环状质粒模板残留对克隆阳性率的影响。当模板为环状质粒时,扩增产物建议用 Dpn I 消化后使用。
注意:通过胶回收纯化 PCR 产物,推荐纯化后通过琼脂糖凝胶电泳检测其质量和浓度,可同时与 DNAMarker比较亮度检测浓度。
2. 插入片段的制备
1)引物设计原则
插入片段扩增引物由两部分构成:重叠区域+特异性引物,即在插入片段的正/反向引物的 5’端引入待重组的线性化载体末端 15~25 nt 的序列(推荐 18 nt,不包括酶切位点),使得扩增后的插入片段末端带有和线性化载体末端一致的同源序列。
F 正向引物(5’-3’):上游载体重叠区域+酶切位点(可选)+正向特异性引物扩增序列
R 反向引物(5’-3’):下游载体重叠区域+酶切位点(可选)+反向特异性引物扩增序列
注意:
a. 若载体为粘性末端,且 3' 端突出,则引物设计必须包含突出部分;若 5'端突出,则引物设计可以包含突出部分,也可以不包含;
b. 尽量选择无重复序列且 GC 含量均匀的区域进行克隆,当载体克隆位点上下游 25 nt 区域内 GC 含量为 40%~60%时,重组效率最高;
c. 计算扩增引物 Tm 值时,只需计算特异性引物的 Tm 值,引入的额外序列无需计算。
示例一:单个插入片段扩增引物设计(以 Hind III 和 Xho I 双酶切线性化载体为例)

示例二:多个插入片段扩增引物设计(以 Hind III 和 Xho I 双酶切线性化载体为例)

注意:
插入多个片段时引物设计:第一片段的上游引物和第三片段的下游引物,分别按照单片段插入的方式引入载体两端的同源序列即可;片段间同源序列引物设计有三种方式:
a. 以前一片段 3' 端 15~25 nt 作为同源序列添加至后一片段 5' 端(如示例二图所示);
b. 以后一片段 5' 端 15~25 nt 作为同源序列添加至前一片段 3' 端;
c. 两片段各取一部分作为同源序列(总计 15~25 nt),分别添加至另一片段末端。
3. 重组反应(推荐 10 μL 体系)
1)体系的配制
| 组分 | 目的重组 | 阴性对照 1③ | 阴性对照 2④ | 阳性对照(可选)⑤ |
| 2×Uniclone Seamless Cloning Mix | 5 μL | 5 μL | 5 μL | 5 μL |
| 线性化载体(50~200 ng)① | X μL | X μL | 0 μL | 1 μL (pUC19 ControlPlasmid,Linearized ) |
| 插入片段(10~200 ng)② | Y μL | 0 μL | Y μL | 1 μL (ControlFragment ) |
| ddH2O | Up to 10 μL | Up to 10 μL | Up to 10 μL | Up to 10 μL |
①:最适载体用量 (ng) = 0.02×载体碱基对数,即 0.03 pmol;
②:最适片段用量(ng)= 0.04×片段碱基对数,插入多片段,每片段最适用量(ng)= 0.02×片段碱基对数。若插入单片段的长度大于载体,则应互换载体与插入片段用量;若插入片段的长度小于 200 bp,则插入片段应使用 5 倍载体用量;③:检验线性化载体中有无背景质粒残留;
④:当插入片段扩增模板是与克隆载体抗性相同的环状质粒时,推荐进行;
⑤:用来排除其他操作因素的影响。
注意:
a. 若按上述公式计算得到的用量超过最低/最高值,则建议直接按最低/最高用量使用;
b. 若载体片段过长、插入片段过长或片段数过多,克隆阳性率均会降低;
c. 若某一组分浓度过高可适当稀释后使用,每个组分的用量最好不低于 1 μL。
2)反应条件
将上述各个成分轻柔混匀(避免产生气泡,请勿涡旋操作),按如下条件进行反应:
| 插入片段 | 反应条件 |
| 1~2 个插入片段 | 50℃,5~15 min |
| 3~5 个插入片段 | 50℃,15~30 min |
当载体骨架>10 kb 或插入片段>4 kb 时,建议延长反应时间至 30~60 min。
注意:
a. 推荐使用 PCR 仪等温控较精准的仪器反应,反应时间不足或太长克隆效率均会降低;
b. 50℃反应完成后,建议进行瞬时离心,将反应液收集至管底;
c. 将反应管置于冰上冷却,建议即时转化。
4. 转化
1) 取 100 μL 冰浴上融化的感受态细胞,加⼊适量重组产物(体积不超过所用感受态细胞体积的
1/10),轻轻混匀,冰上静置 25 min;
2) 42℃水浴热激 45 s,迅速转移⾄冰浴中,静置 2 min;
3) 向离心管中加⼊700 μL 不含抗⽣素的⽆菌培养基(2×YT 或 LB),混匀后 37℃,200 rpm 复苏1 h;
4) 根据实验需要,吸取不同体积的复苏液均匀涂布到含相应抗⽣素的 2×YT 或 LB 培养基上,将平板倒置放于 37℃培养箱过夜培养。
5. 阳性克隆的鉴定
1) 菌落/菌液 PCR 鉴定:用枪头挑取单菌落至 10 μL 无菌水中混匀后取 1 μL 为模板,或直接蘸取菌落至 PCR 体系中扩增(建议至少使用一条通用引物,避免假阳性结果);
2) 以质粒为模板 PCR 鉴定:挑取单克隆至含相应抗生素的 LB 培养基中,37℃,200 rpm 过夜摇菌后抽提质粒作为模板,可使用载体通用引物或特异性引物扩增;
3) 酶切鉴定(若有需要):挑取单克隆至含相应抗生素的 LB 培养基中,37℃,200rpm 过夜摇菌后抽提质粒,使用相应内切酶酶切质粒后电泳检测片段大小;
4) 测序:建议使用载体通用引物测序鉴定。
常见问题与解决办法
Q1:克隆数少或不长克隆?
A1:
1) 引物设计有误。设计及合成引物时,注意反向引物的序列顺序;
2) 插入片段纯度差。对载体和插入片段进行胶回收纯化,电泳检测胶回收产物后再进行连接反应;不推荐多管样品过⼀个柱子的方式回收 DNA,会造成更多的 EDTA、胍盐等杂质残留,抑制反应;用于重组反应的胶回收产物请溶解于 ddH2O 中;
3) 线性化载体或插入片段比例不佳。请严格按照说明书推荐的方法计算各组分用量,用琼脂糖凝胶电泳检测样品质量及浓度;
4) 感受态效率低。自制感受态随着保存时间的增加,效率可能会降低,建议尽量使用新鲜感受态或高效的商业化感受态。
Q2:多数克隆不含插入片段?
A2:
1) 克隆载体及片段中含有质粒背景。酶切制备线性化载体时,提高快速内切酶的使用量,延长反应时间,使用胶回收纯化酶切产物;制备插入片段时尽量使⽤预线性化质粒作为扩增模板,扩增产物进行 DpnⅠ消化及凝胶回收纯化;
2) 相同抗性质粒污染。注意实验环境的清洁及背景质粒的消除。
Q3:克隆含有不正确的插入片段?
A3:PCR 产物中混有非特异性扩增。推荐优化 PCR 体系,提高特异性,使用凝胶回收 PCR 产物。
Q4:菌落 PCR 无条带或大小不对?
A4:
1) 引物不正确。推荐使用载体的通用引物或至少使用一条通用引物进行菌 P 鉴定;
2) 假阴性结果(插入片段较大)。建议提取质粒为模板进行 PCR 验证或酶切验证。优化 PCR 体系、程序;
3) 重组失败。只有空质粒的条带,说明重组不成功,载体线性化不完全,建议优化载体及片段质量。
仅用于科研,不能用于临床诊断!所有产品仅供科研使用,不得用于人或动物的治疗等任何其他用途,不为任何个人提供产品和服务。以实际收货产品说明书为准,网站说明书仅供参考。
 在线客服1号
在线客服1号