细胞培养是生物学和医学研究最常用的手段之一,可分为原代培养和传代培养两种。原代培养是直接从生物体获取组织或器官的一部分进行培养,也称初代培养。严格地说即从体内取出组织接种培养到第一次传代阶段,但实际上,通常把第一代至第十代以内的培养细胞统称为原代细胞培养。一般持续1-4周。此期细胞呈活跃的移动,可见细胞分裂,但不旺盛。原代培养细胞与体内原组织在形态结构和功能活动上相似性大。由于培养的细胞刚刚从活体组织分离出来,故更接近于生物体内的生活状态。这一方法可为研究生物体细胞的生长、代谢、繁殖提供有力的手段。同时也为以后传代培养创造条件。原代培养的过程指动物的组织或器官从机体取出后,经机械法或各种酶类(常用胰蛋白酶)和鳌合剂(常用EDTA)处理,使之分散成单个细胞,加入适量培养基,置于合适的培养容器中,在无菌、适当温度和一定条件下,使之生存、生长和繁殖的过程。
原代细胞培养基由补充了适当的生长因子和细胞因子的基础培养基组成。细胞在细胞培养箱中生长并维持在适当的温度和混合气体中(对于哺乳动物细胞,通常为37°C,5%CO2)。培养条件根据细胞类型而广泛变化。生长培养基的pH,葡萄糖浓度,生长因子和其他营养物质的存在可能会有所不同,具体取决于细胞类型。在建立原代培养过程中,必须在生长培养基中加入抗生素以抑制从宿主组织引入的污染。抗生素可能包括庆大霉素,青霉素,链霉素和两性霉素B的混合物。但是,不建议长期使用抗生素,因为某些试剂(例如两性霉素B)从长期来看可能对细胞有毒。
常见的原代细胞类型:上皮细胞、内皮细胞、成纤维细胞、角质形成细胞、黑色素细胞、神经元、星形胶质细胞、肝细胞、骨骼肌细胞、平滑肌细胞、成骨细胞、肌细胞、软骨细胞、脂肪细胞、滑膜细胞、毛细胞、血细胞、干细胞。
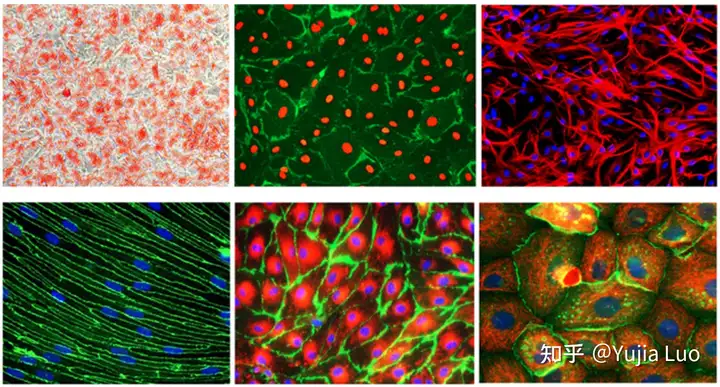
图1. 生物医学研究中常用的原代细胞举例
原代细胞的优缺点
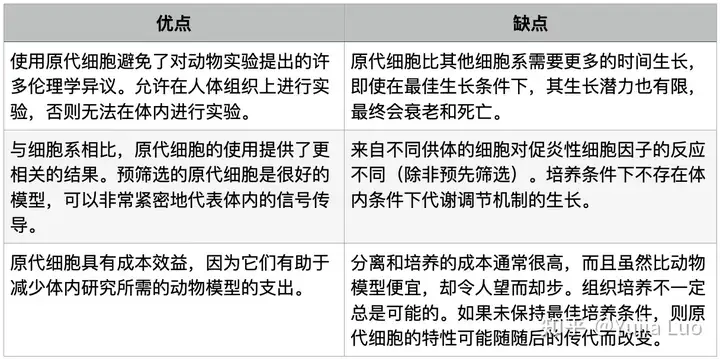
表1. 原代细胞系特征概述
原代细胞 VS. 细胞系
连续细胞系已经获得了通过随机突变或通过故意修饰(例如癌症基因的人工表达)转化的癌细胞系中的无限增殖(永生化)的能力。连续细胞系通常比原代细胞更坚固,更易于操作。它们具有无限的增长潜力,是获取基本信息的快速简便方法。使用连续细胞系的一些缺点是它们是经过基因修饰/转化的,可以改变生理特性并且不代表体内状态,并且随着时间的流逝,这可能会进一步改变。
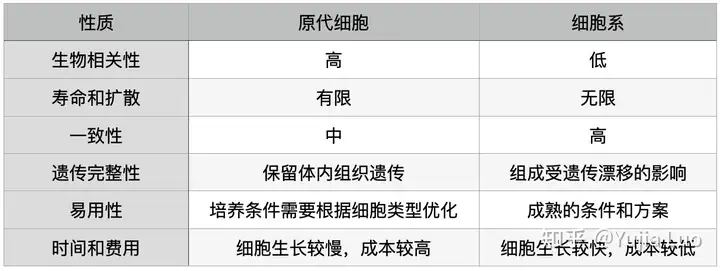
表2. 原代细胞和细胞系之间的特点比较
原代细胞培养应用
原代细胞培养越来越多地用作细胞和分子生物学的主要工具,为研究细胞的正常生理学和生物化学(例如,代谢研究、衰老、信号研究),药物和有毒化合物的作用提供了出色的模型系统。细胞以及诱变和致癌作用。它也可用于药物筛选以及大规模开发生物化合物(例如,疫苗、治疗性蛋白质)。
3D细胞培养:由于原代细胞是未转化的且不会永生化,因此它们紧密模拟了活体模型,产生了更具生理意义的结果,可用于模拟3D组织。这些细胞可以作为模型系统来研究细胞生物学和生物化学,研究细胞与致病因子(如细菌、病毒)之间的相互作用,研究药物的作用,研究衰老过程,研究细胞信号和代谢调节。在许多情况下,使用原代细胞可使研究人员避免使用动物模型所涉及的复杂性(可用性、成本和伦理)。
癌症研究:原代细胞可能会暴露于辐射、化学物质和病毒中,从而使其癌变。因此,可以研究癌症的机制和原因以及信号通路的改变。它也可以用于确定癌细胞的有效药物。在这种情况下,还可以研究癌症治疗(化学疗法和放射疗法)对正常细胞的副作用。
病毒学:可以研究病毒的检测、分离、生长和发育周期。原代细胞也可用于研究感染方式。
药物筛选和毒性测试:原代细胞培养用于研究新药(以研究效果和安全剂量)和/或药物载体(纳米颗粒)的细胞毒性。在工业规模上可用于合成或生产各种生物分子。这在制药行业特别有用。使用原代细胞的基于细胞的治疗产品的各种研究项目正在开发中。原始培养物被用作动物模型的替代品,以测试新药、化妆品和化学药品的效果,它们还用于确定新药的最大允许剂量。
疫苗生产:主要的动物细胞用于生产病毒,而这些病毒用于生产疫苗(例如,使用动物细胞培养来生产脊髓灰质炎、狂犬病、水痘、麻疹和乙肝等致命疾病的疫苗)。
基因工程:原代细胞培养物可用于生产商业上重要的基因工程蛋白质,例如单克隆抗体,胰岛素,激素等。
组织或器官置换:原代细胞培养物可用作置换组织或器官。利用原代细胞重建受损组织或替换无功能的细胞或组织的研究正在进行中。器官培养技术和研究正在胚胎和成人干细胞培养上进行。这些细胞具有分化为许多不同类型的细胞和器官的能力。通过控制这些细胞的发育和分化,我们也许能够治疗多种医学疾病。原代细胞也已广泛用于3D生物打印应用中。
干细胞疗法:从骨髓、血液或胚胎中分离出来的干细胞涉及原代细胞培养。患者自己的干细胞或来自供体的干细胞在体外生长,以产生足够的细胞,这些细胞可用于再生组织或替代功能缺陷的细胞。这个领域正在探索中,以设计针对遗传疾病、脊髓损伤、退行性疾病和癌症的疗法。
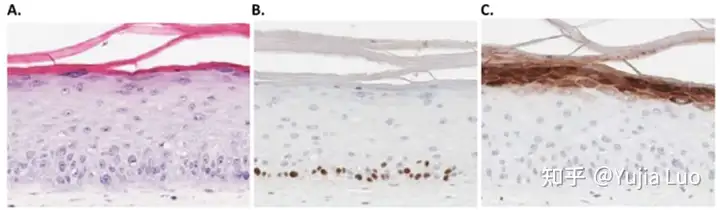
图2. 3D人体皮肤模型可以用作化妆品行业动物测试的替代方法:A)H&E染色; B)BrdU染色;和C)使用人类原代皮肤成纤维细胞,角质形成细胞和黑素细胞对3D皮肤模型进行丝蛋白染色。
原代细胞培养技巧和窍门
1. 生长需求(Growth Requirements)
原代细胞可以悬浮培养或贴壁培养。一些细胞自然地悬浮在悬浮液中,而不附着在表面上(例如,来源于外周血的细胞)。也有一些细胞系经过修饰可以在悬浮培养中存活,它们的生长密度高于粘附条件所允许的密度。对于依赖贴壁的原代细胞,贴壁细胞(例如实体组织)需要一个表面才能在体外正常生长。这些细胞大多在没有涂层的扁平塑料容器中培养,但有时在微载体上培养,可以用细胞外基质蛋白(如胶原蛋白和层粘连蛋白)包被,以增加粘附特性并提供生长和分化所需的其他信号。细胞培养基由补充了适当的生长因子和细胞因子的基础培养基组成,细胞在细胞培养箱中生长,并维持在适当的温度和混合气体中(对于哺乳动物细胞,通常为37°C,5%CO2)。培养条件根据细胞类型而广泛变化,生长培养基的pH、葡萄糖浓度、生长因子和其他营养物质的存在可能会有所不同,具体取决于细胞类型。
在建立原代培养过程中,必须在生长培养基中加入抗生素以抑制从宿主组织引入的污染。抗生素可能包括庆大霉素,青霉素,链霉素和两性霉素B的混合物。但是,不建议长期使用抗生素,因为某些试剂(例如两性霉素B)从长期来看可能对细胞有毒。
分离后保留原代细胞的活力非常重要,因为它们中的大多数会经历衰老过程,并在一定数量的种群倍增后停止分裂。为了使细胞长期存活,必须具备出色的细胞培养操作技能以及适当的培养条件(即生长培养基、温度、气体混合物、pH、生长因子浓度、营养物质和葡萄糖等)。用于补充培养基的生长因子通常来自动物血液(血液来源的成分具有污染的可能性),建议尽可能减少或消除这些成分的使用,操作时也需要使用无菌技术。
2. 细胞融合(Cellular confluence)
细胞融合通常是指附着的细胞在培养容器中所占的百分比。例如,100%的细胞融合意味着培养皿表面被细胞完全覆盖,而50%的细胞融合意味着大约一半的表面被覆盖。跟踪和评估原代细胞培养是一个重要且必不可少的参数,因为各种细胞类型需要不同的融合终点,此时需要对其进行传代培养。
3. 继代保持(Maintenance and Subculture)
当分离的细胞附着在培养皿表面时,细胞的维持阶段开始。通常,培养开始后约需要24小时。当细胞达到所需的细胞融合百分比并活跃增殖时,就该进行传代培养了。这是在达到100%融合之前传代原代细胞培养的最佳时间,因为融合后的细胞可能会发生分化,并在传代后显示出较慢的增殖。
依附依赖性细胞以单层生长,需要定期用适当的培养基传代培养以维持指数生长。单层的继代培养涉及细胞间和细胞内表面间键的断裂,大多数粘附的原代细胞需要消化它们的蛋白质附着键,或者需要用低浓度的蛋白水解酶(例如胰蛋白酶/ EDTA)从单层或相关组织中分离出来。细胞解离并分散成单细胞悬液后,将它们计数并稀释至适当的浓度,然后转移至新鲜的培养容器中(培养基的组成取决于细胞类型而有所不同),在此处它们会重新附着并分裂。
4. 细胞计数(Cell counting)
血细胞计数器通常用于使用排阻染料锥虫蓝估计细胞数和确定细胞活力。血细胞计数器是相当厚的玻璃显微镜载玻片,带有矩形凹痕,可形成一个腔室。腔室上刻有垂直线的激光蚀刻栅格,并且精心制作了该设备。由线界定的面积和腔室的深度是已知的。因此,可以对特定体积的流体中的细胞数进行计数,从而计算出整个流体中的细胞浓度。
5. 冷冻保存和恢复(Cryopreservation and Recovery)
低温保存是使用低温保存结构完整的活细胞的过程。冷冻保存和融化原代细胞是必不可少的,以最大程度地减少每个过程中的细胞损伤和死亡。对于原代细胞,可通过使用冷冻保护剂(例如DMSO或甘油,在正确的温度和受控的冷冻速率下)实现。对于大多数原代细胞,可以在80%完全生长培养基的混合物中添加10%FBS和10%DMSO进行冷冻保存。冷冻过程需要以每分钟-1°C的速度缓慢进行,以最大程度地减少细胞内冰晶的形成。冷冻的培养物需要以液氮(-196°C)或低于-130°C的气相存储。
解冻冷冻保存的细胞是快速的过程,方法是将冷冻的细胞浸入37°C水浴约1-2分钟。注意不要在融化后离心原细胞(因为它们对冷冻保存恢复过程中的损伤极为敏感)。最好在融化后直接铺板细胞,并允许培养物在最初的24小时内附着。当启动冷冻保存的原代细胞培养时,必须在细胞附着后去除用过的培养基(因为DMSO对原代细胞,并可能导致解冻后活力下降)。
原代细胞培养过程中可能存在的错误
污染:转移主要组织进行培养时需要注意避免污染。
pH值变化:这可能是由于培养基中的盐分不正确,细菌或真菌污染,碳酸氢盐缓冲液不足,二氧化碳张力不正确等引起的。
粘附性不足(细胞不贴壁):培养基中不含附着因子(attachment factors)或附着因子不足,培养皿或培养基污染,细胞被胰蛋白酶过度消化等。
生长缓慢:原因包括培养基的pH值变化,必需的促进生长的成分/因子耗尽,低污染,试剂储藏不当等。
细胞死亡:温度波动,二氧化碳含量过低,在融化和/或冷冻保存过程中细胞受损,有毒代谢产物浓度增加,培养基中的渗透压失衡导致细胞存活率降低。
沉淀(pH不变):由于使用了冷冻培养基,在pH不变的培养基中可能会出现沉淀,残留的磷酸盐残留在用洗涤剂洗涤时可能会沉淀出粉末状的培养基成分。
细胞结块(细胞不贴壁且结块):悬浮细胞可能由于钙、镁离子的存在(贯流时应使用不含钙、镁离子的D-Hank’s缓冲液(D-HBSS),而不能选择含有钙、镁离子的HBSS或可能含有钙、镁离子的PBS缓冲液)或细胞裂解及DNA释放(过度用蛋白水解酶消化)而结块。
诱导变异性:多种试剂和培养基会诱导原代细胞的数据产生变异,研究者的处理手法也可能导致原代细胞的数据产生变异。
 在线客服1号
在线客服1号




