5’RACE试剂盒
产品及特点
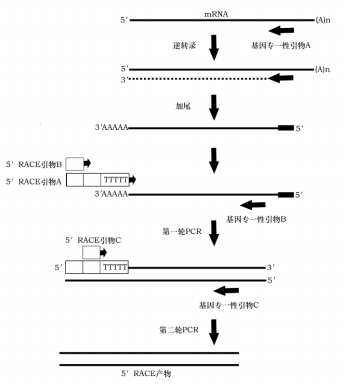
研究真核基因的最基础的工作之一就是确定其转录起始位点,目前最通用的方法是 5′-RACE 法,RACE(Rapid Amplification of cDNA Ends)是 Frohman发明的、通过 PCR 快速克隆 cDNA 末端的技术,它在不建立 cDNA 文库的前提下,利用已知 cDNA 序列设计引物,通过往两端延伸和扩增获得其 5′-端序列。本试剂盒就是根据 5′-RACE 原理而开发,它具有下列特点:
1. 即开即用,客户不需要单独准备各种材料。
2. 反应条件经过精心优化,包括使用无 RNase H 活性的 MMLV 和优化的引物。
5′-RACE 的原理如下图:
规格及成分


自备试剂Poly(A) RNA(或总 RNA)、基因专一性引物 A、B、C、75%乙醇。注意:自备的基因专一性引物 A,B,C 的相对位置必须跟本手册产品介绍中的示意图一致。
运输及保存 低温运输、-20℃保存、有效期一年。
使用方法
1. 变性模板 RNA:将 1 μg mRNA 或 5 μg 总 RNA 加入到一个 RNase-free 的塑料管中,补 RNase-Free 水到 10 μL,65℃保温 5 分钟后短暂离心,立即放冰上待用。如果 RNA 浓度偏低,加 RNase-Free 水之前体积就已超过 10μL,则需要使用本公司的核酸浓缩剂(需另购,编号为 110801)浓缩到所需的体积。
2. 在塑料管中按顺序加入:
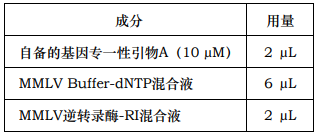
3. 37℃保温 60 分钟, 42℃保温 30 分钟, 50℃保温 10 分钟,最后 75℃保温10 分钟使逆转录酶变性。短暂离心 5 秒后待用。
4. 在塑料管中加入 40μL 微量核酸沉淀剂(含不溶的核酸助沉剂,用前需要充分摇匀再取用),震荡混匀。
5. 室温 12000 rpm 离心 15 分钟,沉淀即为 cDNA。小心吸弃上清。此步沉淀可以去除多余的 dNTP,否则它们会干扰下步的 TdT 加尾反应。
6. 加入 1mL 自备 75%乙醇,室温 12000 rpm 离心 5 分钟,小心吸弃上清。此步可以洗去逆转录反应中的盐离子。
7. 短暂离心数秒,小心吸弃残留液体后,晾干后加入 20 μL RNase-free 水,充分吹打溶解 cDNA 沉淀。注意:为保证加尾效率,溶解 cDNA 的 RNase-free水最好不要超过 20 μL。
8. 在两个塑料离心管中按下表设置加尾反应:

9. 37℃保温 15 分钟进行加尾反应,然后 75℃保温 3 分钟灭活末端转移酶。在反应管中分别加入 0.5 mL RNase-free 水稀释样品和阴性对照。此25倍稀释液将作为下步 PCR 的模板。
10. 第一轮 PCR:按下表分别使用不同体积的样品稀释液和阴性对照稀释液做模板设置 50uL 的 PCR 反应(单位:μL,下表只列出以样品稀释液为模板的反应)。
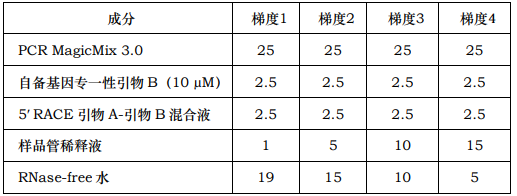
11. 按下列条件进行 PCR(注:应根据自备引物的 Tm 值选择适当的退火温度,下面的参数仅仅供参考)。第 1 次循环:94℃ 5 分,48-52℃ 2 分,72℃ 4 分第 2-30 次循环:94℃ 40 秒,52-60℃ 1 分,72℃ 3 分最后延伸:72℃ 15 分
12. 直接取 20μL PCR 产物进行琼脂糖电泳(不需要上样液)检查 PCR 结果(样品组 4 个样,阴性对照组 4 个样)。如果样品有一条清晰的扩增条带,而阴性对照在相应的位置没有扩增产物,则可以不做后续的第二轮 PCR,直接进行 DNA测序或切胶克隆。如样品没有一条清晰的扩增条带,则进入第二轮 PCR。
13. 第二轮 PCR:从 8 管 PCR 产物中各取 1μL 分别加入到 20 μL RNase-free 水中进行稀释 20 倍,再各取 1 μL 分别作为第二轮 PCR 的模板,共 8 个反应:
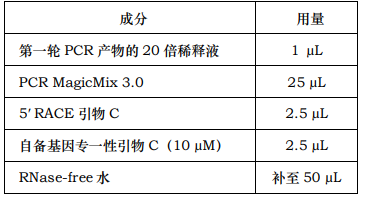
14. 按下列条件进行 PCR:第 1-30 次循环(94℃ 40 秒,52-60℃ 1 分,72℃ 3分),最后延伸:72℃ 15 分
15. 直接取 20μL PCR 产物进行琼脂糖电泳(不需要上样液),一般都会有一个样品有清晰的条带出现,则可以直接进行 DNA 测序或 TA 克隆。
仅用于科研,不能用于临床诊断!所有产品仅供科研使用,不得用于人或动物的治疗等任何其他用途,不为任何个人提供产品和服务。
 在线客服1号
在线客服1号