3’RACE试剂盒
产品及特点
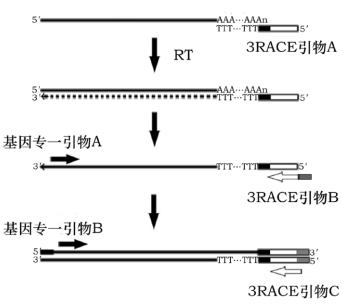
研究真核基因的最基础的工作之一就是确定其转录终止位点,目前最通用的方法是 3′-RACE 法,RACE(Rapid Amplification of cDNA Ends)是 Frohman发明的、通过 PCR 快速克隆 cDNA 末端的技术,它在不建立 cDNA 文库的前提下,利用已知 cDNA 序列设计引物,通过往两端延伸和扩增获得其 3′-端序列。本试剂盒就是根据 3′-RACE 原理而开发,它具有下列特点:
1. 即开即用,客户不需要单独准备各种材料。
2. 反应条件经过精心优化,包括使用无 RNase H 活性的 MMLV 和优化的引物。
3′-RACE 的原理如下图:
规格及成分
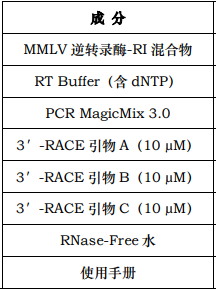

自备试剂 Poly(A) RNA(或总 RNA)、基因专一性引物 A、基因专一性引物 B、超纯水。
运输及保存 低温运输、-20℃保存、有效期一年。
使用方法
一:引物的设计和准备工作
利用已道序列的区域设计基因专一性引物三条(A、B),其中引物 B 和 A 引物比较,靠 3’端 10-30 个碱基,类似巢式 PCR 的引物设计。自备的基因专一性引物的 Tm 最好跟 3′-RACE 引物 B 和引物 C 的一致,即 Tm 为 58℃。引物合成后加超纯水使其浓度为 10 μM,放冰上待用。
二:利用含 Oligo(dT)的 3’-RACE 引物 A 进行逆转录
注意:MMLV 酶使用前必须短暂离心,因为它含 50%甘油,及其粘稠,否则将取不到所需体积。
1. 在一个 PCR 管中,加入以下组分:
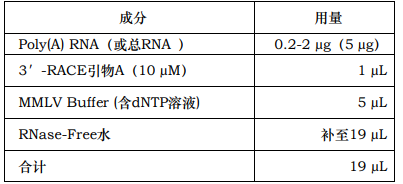
注意:如果可能,最好使用Poly(A) RNA作为模板。
2. 65℃保温 5 分钟, 展开 RNA 的二级结构,立即冰浴待用。
3. 在冰浴的 PCR 管中加入 1 μL MMLV 逆转录酶-RI 混合物。
4. 先 37℃保温 60 分钟,再 42℃保温 30 分钟进行逆转录反应,最后 50℃保温10 分钟终止反应。
5. 加入 0.5 mL RNase-free 水稀释上步得到的 cDNA,冰浴待用。长期放置需要放-20℃保存。
三:利用基因专一性引物 A 和 3′ RACE 引物 B 进行第一轮 PCR
6. 用不同量的 RT 反应液(即稀释后的 cDNA 模板)设置 PCR,样品组需要设置模板用量梯度,单位:μL。
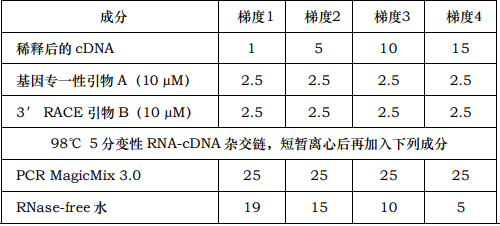

7. 按下列参数进行 cDNA 第二链的合成和 PCR:第 1 步,cDNA 第二链的合成:52-60℃ 2分钟,72℃ 40 分钟(此步的目地是合成第二链的 cDNA,复性温度需要根据自备基因专一性引物 A 的 Tm值决定,一般可以从 55℃开始)。第二步 PCR 循环:94℃ 1分钟,52-60℃ 1分钟,72℃ 3分钟,循环数30。(此步为 PCR 扩增,复性温度需要根据自备基因专一性引物 A 的 Tm值决定,一般可以从 55℃开始)。最后延伸:72℃ 15 分钟。
8. 取 5 μL PCR 反应液进行琼脂糖凝胶电泳以确认 PCR 扩增产物。若得到目的扩增产物需要用于后续实验,请于-20℃保存;若没有得到目的扩增产物,可按下列步骤进行巢式 PCR 反应。
四:利用基因专一性引物 B 和 3′ RACE 引物 C 进行巢式 PCR 反应
9. 将上轮 PCR 产物(4 管)用水稀释约 20 倍(在 50μL PCR 反应液中加入 1mL超纯水),然后分别作为模板进行巢式 PCR 扩增。PCR 反应设置如下:

10. PCR 反应。按下列条件进行 PCR:
第 1-30 次循环:94℃ 1分钟,52-60℃ 1分钟,72℃ 3分钟(复性温度需要根据自备基因专一性引物 B 的 Tm 值进行优化,一般可以从 55℃开始)。最后延伸:72℃ 15 分钟。
11. 电泳检测。然后根据实验结果进行 DNA 测序或 TA 克隆。
仅用于科研,不能用于临床诊断!所有产品仅供科研使用,不得用于人或动物的治疗等任何其他用途,不为任何个人提供产品和服务。
 在线客服1号
在线客服1号