考马斯亮蓝法蛋白含量测试盒说明书
注意:正式测定之前选择 2-3 个预期差异大的样本做预测定。
测定意义:
样品可溶性蛋白质含量常常用于酶活性计算。此外,可溶性蛋白质含量也用于食品等质量分析。
测定原理:
在酸性溶液中,考马斯亮蓝 G-250 与蛋白质结合形成蓝色复合物;该复合物在 620nm 处有最大吸收峰,其颜色的深浅与蛋白质的浓度成正比。该方法灵敏度高,适合微量蛋白质分析。
自备仪器和用品:
离心机、酶标仪、96 孔板、移液器和蒸馏水。
试剂组成和配制:
试剂一:液体 11 mL×1 瓶,4℃保存。
样品中可溶性蛋白质提取:
1. 液体样品:澄清液体样品可以直接测定。
2. 组织样品:按照组织质量(g):提取液体积(mL)为 1:20 的比例(建议称取约 0.05 g 组织,加入 1mL 提取液(自备,根据需要选用酶提取缓冲液或者蒸馏水或者生理盐水))冰浴匀浆,8000g,4℃离心 10min,取上清,即待测液。(动物样品常常需要稀释)
3. 细菌、真菌:按照细胞数量(104 个):提取液体积(mL)为 500~1000:1 的比例(建议 500 万细胞加入 1mL 提取液),冰浴超声波破碎细胞(功率 300w,超声 3 秒,间隔 7秒,总时间 3min);然后 8000g,4℃,离心 10min,取上清置于冰上待测。
测定操作:
1. 酶标仪预热 30 min。
2. 在 96 孔板中加入:
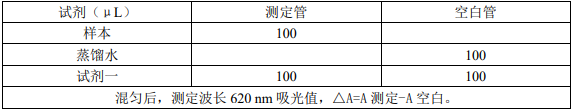
注意:
1、 空白管只需要测定一次。
2、 测定管的待测样品蛋白质浓度要控制在 1-100μg/mL 范围内,尽量控制在中间范围。
3、 测定管若出现浑浊或分层现象,就说明蛋白含量较高,通常须将待测液用提取液稀释10~20 倍后重新检测。
计算公式:
标准曲线:y = 7.1265x - 0.0007;R2 = 0.9997;x: 蛋白标准品浓度(mg/mL;线性范围为 0.001~0.1mg/mL); y: 吸光值差值
1.按液体样本体积计算:Cpr(mg/mL)=(△A+0.0007)÷7.1265
=0.1403×(△A+0.0007)
2.按组织样本质量计算: Cpr(mg/g 鲜重)=(△A+0.0007)÷7.1265×V 总÷W
=0.1403×(△A+0.0007)÷W
V 总:提取液体积,1 mL; W:样本质量,g。
仅用于科研,不能用于临床诊断!所有产品仅供科研使用,不得用于人或动物的治疗等任何其他用途,不为任何个人提供产品和服务。以实际收货产品说明书为准,网站说明书仅供参考。
 在线客服1号
在线客服1号